TINCIONES
Te invitamos a conocer las tinciones más importantes utilizadas en parasitología
¿QUÉ ES UNA TINCIÓN?
Una tinción es un proceso por el cual las moléculas de un colorante se absorben a una superficie con el objetivo de mejorar el contraste en la imagen vista en el microscopio. Los colorantes y tinturas son sustancias que usualmente se utilizan en biología y medicina para resaltar estructuras en tejidos biológicos que van a ser observados con la ayuda de diferentes tipos de microscopios.
Antes de realizar cualquier tipo de tinción se debe considerar......
La tinción de estructuras parasitarias puede ser efímera o permanente. La elección de la técnica está en función del objetivo que se pretenda y de la estructura parasitaria por procesar.
Las preparaciones efímeras son fáciles, rápidas y útiles para observar, discriminar y diagnosticar estructuras parasitarias después de realizar los métodos coproparasitoscópicos (cps): directo en fresco, de concentración/flotación (Faust, Ferreira) o concentración sedimentación (Ritchie).
Para observaciones exhaustivas es preferible hacer preparaciones permanentes con colorantes que permitan mayor contraste, como Giemsa, hematoxilina férrica, negro de clorazol, tricrómica de Gomori-Wheatley y Ziehl-Neelsen.
TINCIONES SECAS
Tinción de Giemsa
En el campo de la parasitología, la tinción de Giemsa ha permitido hacer el diagnóstico de enfermedades parasitarias tales como la malaria, el mal de chagas y la leishmaniasis.
Fundamento
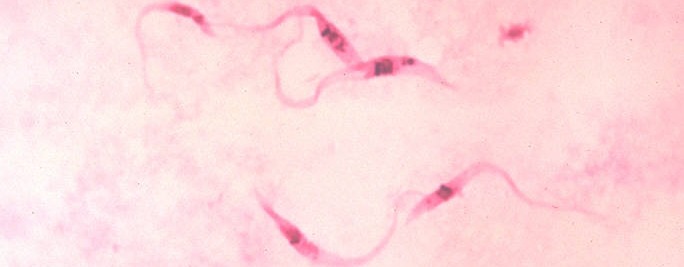
Con esta tinción los núcleos de los parásitos se tiñen de rojo brillante y el citoplasma de color azul. Es útil para identificar Plasmodium, Babesia, Tripanosoma, microfilarias de Onchocerca, Trichomonas, Giardia, etc.
En la figura A se observan parásitos intraeritrocíticos de Plasmodium vivax, y en la figura B trofozoítos de Giardia intestinalis.
Figuras A y B. Preparación permanente que muestra los detalles que pueden observarse en un frotis sanguíneo teñido con la coloración de Giemsa. Note el color de los eritrocitos, del leucocito y de los trofozoítos maduros de Plasmodium vivax dentro de sendos eritrocitos (100×). B) Trofozoítos de Giardia intestinalis teñidos con Giemsa. Citoplasma.
Muestra
En los parásitos Plasmodium sp y el Tripanosoma cruzi pueden visualizarse en sangre periférica de los pacientes infectados, los mismos pueden encontrarse en diversos estadios según la fase en la que esté la enfermedad.
Principalmente es de sangre periférica y en casos de leishmaniasis cutánea puede diagnosticarse al evaluar muestras de biopsias de piel teñidas con Giemsa, donde se encuentra el parásito
Reactivos
- Giemsa II-eosina 0.4 g
- Giemsa II 0.2 g
- Giemsa B-eosina 0.2 g
- Glicerina 50.0 ml
- Metanol 50.0 ml
- Amortiguador de fosfatos
- Amortiguador pH 7.2
Procedimiento
- Hacer un frotis en un portaobjetos y fijar con metanol durante un minuto.
- Introducir las laminillas en la solución de trabajo durante 20 a 30 minutos.
- Lavar cuidadosamente con amortiguador de fosfatos (pbs1x) y después con agua destilada.
- Escurrir y secar a temperatura ambiente.
- Montar con resina Entellan.
- Observar al microscopio con aceite de inmersión.
La Tinción de Giemsa se recomienda más para el diagnóstico parasitológico de leishmaniasis, de muestras cutáneas.
Tinción tricrómica de Gomori-Wheatley
Fundamento
Al principio, la tinción de Gomori se utilizó en tejidos y Wheatley la usó en parásitos; este método es más rápido que el de hematoxilina férrica. Se usa para la coloración de trofozoítos y quistes de protozoarios intestinales, en donde se pueden ver algunos detalles del citoplasma y el núcleo.
Muestra
Se utilizan heces frescas o fijadas en solución fijadora de alcohol polivinílico (PVA) o preservadas con la solución de acetato de sodio - ácido acético - formaldehído (SAF).
Se realiza un frotis fino y se deja secar al aire o al calor a 60°C.
Reactivos
Solución concentrada
- Cromotropo 2R 0.6 g
- Verde brillante SF 0.3 g
- Ácido fosfotúngstico 0.7 g
- Ácido acético 1.0 ml
- Agua destilada 100.0 ml
Xileno
Los reactivos secos son colocados en un frasco, se añade el ácido acético, se mezcla y debe dejarse reposar durante 30 minutos. Luego se agrega el agua y se mezcla. Esta solución puede durar varios años.
Procedimiento
Para frotis preservados en pva, sumergirlos en jarra de coplin con etanol al 70 % + yodo 10 minutos. En caso de otros preservadores, seguir las instrucciones del fabricante. No se realiza el paso del yodo en muestras que contengan cloruro de mercurio como preservante.
- En una laminilla hacer un frotis y emulsionarlo con solución salina isotónica; es necesario que la capa quede delgada. Antes de que las heces se sequen, se fija con Schaudinn durante 60 minutos (se pueden dejar toda la noche en el fijador).
- Para eliminar el exceso de cloruro de mercurio del fijador de Schaudinn, las laminillas son colocadas en alcohol a 70%-yodo durante un minuto.
- Se lavan dos veces con etanol a 70%, durante un minuto.
- Las laminillas son colocadas en la solución concentrada de cinco a 10 minutos.
- Se transfieren a etanol a 90% con 1% de ácido acético (10 a 15 segundos).
- Se sumergen dos veces en etanol absoluto.
- Se ponen en etanol absoluto durante 30 segundos.
- Se meten en xileno durante un minuto.
- Las preparaciones se cubren con resina o bálsamo de Canadá, se les coloca un cubreobjetos del número 1 y se dejan secar.
Los protozoarios adquieren diferentes tonalidades. El fondo se ve sobre todo rojo o verde, en tanto que los protozoarios toman un color más neutro, casi siempre gris o verde pálido. Los cuerpos cromatoides y eritrocitos toman tanto el color rojo como el colorante verde, con lo que se genera un fuerte contraste en el citoplasma; por lo regular los elementos nucleares se tiñen de un color más oscuro.
Figura C: Preparación permanente teñida con tricrómica de Gomori-Wheatley que muestra la coloración que adquieren las arenillas hidatídicas. Note el predominio del color verde en el citoplasma y el color rojo de los ganchos (100×).
Tinciones húmedas
Tinción de Lugol
Fundamento
Es útil para colorear el glucógeno y visualizar los núcleos en los trofozoítos, quistes y ooquistes de protozoarios, puesto que estos adquieren una coloración marrón, excepto los de Cryptosporidium spp, que no se tiñen, diferencia a tener presente.
Es el mejor método para detectar trofozoítos en una amebiasis invasora por Entamoeba histolytica en heces o en otros productos humanos. Sirve para ejecutar cuenta de huevos de algunos helmintos y así estimar la intensidad de la infección.
Muestra
Heces frescas recolectadas en un frasco de vidrio, plástico o de cartón, de boca ancha, con tapadera y correctamente etiquetado con la identificación del paciente.
Reactivos
Solución concentrada
- Yoduro de potasio 10.0 g
- Cristales de yodo 5.0 g
- Agua destilada 100.0 ml
Solución de trabajo
- Solución concentrada 5.0 ml
- Agua destilada 15.0 ml
Cuando se prepara la solución de trabajo se debe mantener la relación 1:3 de solución concentrada y agua, debe almacenarse en frascos ámbar y evitar exceso de luz porque el yodo reacciona con la luz y pierde su color.
Procedimiento
El procedimiento consiste en colocar la muestra sobre un portaobjetos, emulsionarla con una gota de lugol, cubrirla con un cubreobjetos y observarla al microscopio con los objetivos de 10x y 40x.
Figura D: Preparación efímera que muestra formas vacuoladas de Blastocystis spp teñidos con lugol. Note la diversidad de tamaños y la prominente vacuola central rodeada por el citoplasma (40×).
Tinción de Tionina
Fundamento
El citoplasma de los protozoarios se tiñe de color rojo-azulado, por lo que se obtiene una mejor diferenciación de los elementos parasitarios y sus estructuras internas. La tionina es un valioso colorante cromático a causa de sus propiedades metacromáticas, usado como colorante vital y además para teñir cortes de tejido humano.
Muestra
Heces frescas recolectadas en un frasco de vidrio, plástico o de cartón, de boca ancha, con tapadera y correctamente etiquetado con la identificación del paciente.
Reactivos
- Tionina: 0,5 g.
- Agua destilada: 200 mL.
- Hidróxido de sodio: 50 mL.
- Etanol 90°: 250 mL.
Procedimiento
Se mezcla una gota del sedimento del enriquecimiento con dos gotas de tionina preparada. Se cubre con laminilla y se espera 5 minutos para que actúe el colorante. Después observar al microscopio 10X y 40X.

Figura E: Hipotálamo con tinción de Tionina
Tinción Cristal Violeta-Safranina
Muestra
Heces frescas recolectadas en un frasco de vidrio, plástico o de cartón, de boca ancha, con tapadera y correctamente etiquetado con la identificación del paciente.
Reactivos
Solución A (estable en el tiempo)
- Cristal violeta 1 gr
- Etanol 6 ml
- Suero Fisiológico 494 ml
Disolver, mezclar bien y filtrar. Guardar en frasco oscuro.
Solución B (Duración 3 meses a T° ambiente)
- Safranina 0,25 gr
- Etanol 10 ml
- Suero Fisiológico 490 ml
Disolver, mezclar bien y filtrar. Guardar en frasco oscuro.
Procedimiento
- Mezclar 4 partes de solucion A con 10 partes de solución B.
- Poner una gota de la tinción en un portaobjetos y sobre esta poner una gota de la muestra, mezclar con un extremo del cubreobjeto y observar al microscopio 10X y 40X.
TINCIONES PARA MUESTRAS DE HECES
Tinción ácido-rápido modificado
Fundamento
Esta técnica es útil para la identificación de ooquistes de las especies de coccidios ( Cryptosporidium , Cystoisospora y Cyclospora ), que pueden ser difíciles de detectar con tinciones de rutina como el tricrómico.
Muestra
Se puede utilizar sedimento concentrado de heces frescas o conservadas en formalina. También se pueden teñir otros tipos de muestras clínicas, como líquido duodenal, bilis, muestras pulmonares (esputo inducido, lavado bronquial, biopsias).
Reactivos
- Metanol absoluto
- Alcohol ácido: 10 ml de ácido sulfúrico + 90 ml de etanol absoluto. Se almacena a temperatura ambiente.
- Carbol fucsina de Kinyoun
- Verde malaquita al 3%: disolver 3 g de verde malaquita en 100 ml de agua destilada. Se almacena a temperatura ambiente.
Procedimiento
- Prepare un frotis con 1 a 2 gotas de muestra en el portaobjetos y seque en un calentador de portaobjetos a 60 ° C hasta que se seque.
- Fijar con metanol absoluto durante 30 segundos.
- Teñir con carbol fucsina de Kinyoun durante un minuto. Enjuagar brevemente con agua destilada y escurrir.
- Eliminar con alcohol ácido durante 2 minutos. Enjuagar con agua destilada y escurrir.
- Contratinar con verde malaquita durante 2 minutos. Enjuagar brevemente con agua destilada y escurrir.
- Secar en un calentador de portaobjetos a 60 ° C durante unos 5 minutos. Monte con un cubreobjetos usando el medio de montaje deseado.
- Examine de 200 a 300 campos con objetivos de 40 × o más. Para confirmar la morfología interna, utilice un objetivo de inmersión en aceite de 100 ×.
Tinción con cromótopos
Fundamento
Este método de tinción se desarrolló en los CDC utilizando varios componentes del método de tinción tricrómica para diferenciar las esporas de microsporidios de los elementos fecales de fondo.
Muestra
Prepare un frotis fino usando aproximadamente 10 µl de suspensión de heces fecales fijadas con formalina al 10% (no concentradas) en un portaobjetos de vidrio. También se pueden usar concentrados de formalina, pero el número de organismos será esencialmente el mismo que antes de la concentración. Fijar con calor en un calentador de portaobjetos a 60 ° C hasta que esté completamente seco (5-10 minutos).
Reactivos
- Metanol absoluto
- Mancha de cromótopo
- Alcohol acido
- Etanol al 95%
- Etanol al 100%
- Xileno o sustituto de xileno
Procedimiento
- Fijar el frotis en metanol absoluto durante 5 minutos.
- Colocar en tinte cromótropo durante 90 minutos.
- Elimine en alcohol ácido durante solo 1 a 3 segundos.
- Enjuague en etanol al 95% por inmersión.
- Colocar en dos cambios de etanol al 100% durante 3 minutos cada uno.
- Coloque dos cambios de xileno o sustituto de xileno durante 10 minutos cada uno.
- Drene el portaobjetos y móntelo con un cubreobjetos utilizando medios de montaje (por ejemplo, permount). Examine el frotis después del secado utilizando al menos una inmersión objetiva en aceite de 100 × o más. Examine al menos 200 a 300 campos de inmersión en aceite.
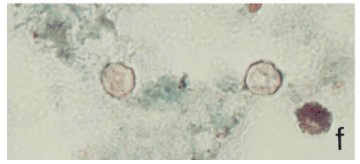
Figura F ; Ooquistes de Cyclospora en frotis fecales con tinción de cromotropo
Tinción con técnica de safranina modificada
Fundamento
Utilizada para detectar especie de Cyclospora , Cryptosporidia y Cystoisospora.
Los ooquistes de Cyclospora en muestras clínicas se demuestran de forma rutinaria mediante tinción acidorresistente modificada (en frío). Sin embargo, con esa técnica, los ooquistes se tiñen de forma variable desde que no se tiñen hasta que se tiñen por completo, lo que conduce a una posible identificación errónea. La técnica de safranina modificada produce una tinción más uniforme de estos ooquistes.
Muestra
Se puede utilizar sedimento concentrado de heces frescas o conservadas en formalina. También pueden teñirse otros tipos de muestras clínicas, como el líquido duodenal.
Reactivos
- Alcohol ácido (3% HCL / Metanol): agregue lentamente 3 ml de ácido clorhídrico a 97 ml de metanol absoluto. Se alamacena a temperatura ambiente en un recipiente bien cerrado.
- Tinción de safranina (disponible en kits de tinción de Gram).
- Verde de malaquita al 3%: disolver 3 g de verde de malaquita en 100 ml de agua destilada. Se almacena a temperatura ambiente.
Procedimiento
- Prepare un frotis fino en el portaobjetos y séquelo en un calentador de portaobjetos.
- Fijar en alcohol ácido durante 5 minutos.
- Enjuague con agua destilada.
- Coloque en safranina hirviendo durante 1 minuto.
- Enjuague con agua destilada.
- Contratinar con verde malaquita durante 1 minuto.
- Enjuagar brevemente con agua destilada.
- Seque el portaobjetos y monte con un cubreobjetos utilizando el medio de montaje deseado.
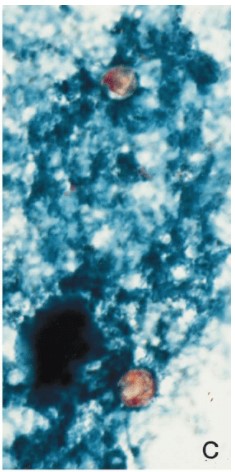
Figura G: Ooquistes de Cyclospora en frotis fecales con tinción de safranina-verde malaquita, con dos ooquistes teñidos de naranja
Tinción tricrómica
Fundamento
En general, se reconoce que las películas fecales teñidas son el medio más productivo de examen de las heces en busca de protozoos intestinales. El frotis teñido permanente facilita la detección e identificación de quistes y trofozoítos y proporciona un registro permanente de los protozoos encontrados. En el frotis teñido a menudo se observan pequeños protozoos que no se detectan en los exámenes de montaje en húmedo (de muestras concentradas o no concentradas). La técnica Wheatley Trichrome para muestras fecales es una modificación del procedimiento de tinción original de Gomori para tejidos. Es un procedimiento rápido y simple, que produce frotis uniformemente bien teñidos de protozoos intestinales, células humanas, levadura y material de artefactos.
Muestra
Las muestras suelen consistir en heces frescas o heces fijadas en alcohol polivinílico (PVA) untadas en portaobjetos de microscopio que se dejan secar al aire o secar en un portaobjetos más cálido a 60 ° C. También se pueden utilizar heces conservadas en acetato de sodio-ácido acético-formalina (SAF) o algunos de los fijadores de un vial.
Reactivos
- Etanol al 70% más yodo: prepare una solución madre agregando cristales de yodo a alcohol al 70% hasta obtener una solución oscura. Para usar, diluir el caldo con alcohol al 70% hasta obtener un color marrón rojizo oscuro o un color de té fuerte.
- Etanol al 70% (dos veces)
- Tinte tricrómico: se puede comprar comercialmente
- Etanol ácido al 90%
- Etanol al 95%
- Etanol 100% (dos veces)
- Xileno o sustituto de xileno (dos veces)
Procedimiento
- Para frotis de PVA, coloque el portaobjetos en etanol al 70% más yodo durante 10 minutos. Para otros fijadores, siga las instrucciones del fabricante. Omita el paso del yodo para conservantes que no contienen cloruro de mercurio.
- Coloque el portaobjetos en etanol al 70% durante 5 minutos.
- Coloque en un segundo etanol al 70% durante 3 minutos
- Colocar en el tinte Trichrome durante 10 minutos
- Destinar en etanol al 90% más ácido acético durante 1 a 3 segundos.
- Enjuague varias veces con etanol al 100%.
- Colocar en dos cambios de etanol al 100% durante 3 minutos cada uno.
- Colocar en dos cambios de xileno o sustituto de xileno durante 10 minutos.
- Monte con cubreobjetos utilizando medio de montaje (por ejemplo, permount).
- Examine el frotis microscópicamente utilizando el objetivo de 100 ×. Examine al menos 200 a 300 campos de inmersión en aceite.
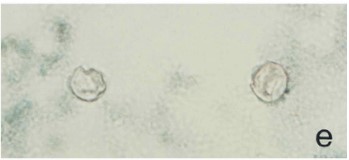
Figura H : Ooquistes de Cyclospora en frotis fecales con tinción tricrómica
Tinción con blanco de calcofluor
Fundamento
Esta técnica quimiofluorescente es útil para la detección de microsporidios, Acanthamoeba spp., Pneumocystis jiroveci y Dirofilaria spp. Los agentes quimiofluorescentes, como Calcofluor, Fungi-Fluor o Uvitex 2B, también conocidos como agentes abrillantadores ópticos, son agentes de filtrado rápidos y económicos. Estos reactivos son sensibles pero inespecíficos ya que muchos objetos y organismos distintos de los parásitos pueden emitir fluorescencia. Esta prueba debe usarse como una herramienta de detección rápida y no para la identificación de especies.
Muestra
Prepare un frotis fino utilizando aproximadamente 10 µl de muestras frescas o conservadas en un portaobjetos de vidrio. Las muestras pueden incluir heces, orina, cultivos u otros tipos de muestras. Fijar con calor en un calentador de portaobjetos a 60 ° C hasta que esté completamente seco (5-10 minutos).
Reactivos
- Metanol absoluto
- Reactivo blanco de Calcofluor al 0,01%: preparar una solución al 0,01% en solución salina tamponada con Tris 0,1 M, pH 7,2
Procedimiento
- Prepare un frotis fino de heces, cultivos u otro material de muestra.
- Fijar el frotis en metanol durante 30 segundos.
- Teñir con reactivo blanco de calcofluor al 0,01% durante 1 minuto.
- Enjuague con agua destilada y deje secar el frotis.
- Monte con un cubreobjetos de grosor n. ° 1.
- Examine con un microscopio de fluorescencia UV equipado con un cubo de filtro azul violeta con una longitud de onda de 400 nm o menos.
- Para detectar microsporidios, examine el frotis con un objetivo de inmersión en aceite de 50 × o 100 ×. Las esporas de microsporidios emitirán una fluorescencia de un color blanco azulado brillante sobre un fondo negro.
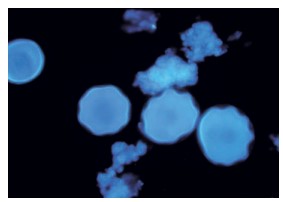
Figura I: Tinción con blanco de calcofluor de Acanthamoeba
OTRAS TINCIONES
Tinción hematoxilina férrica modificada
Fundamento
La hematoxilina férrica es una de las técnicas de tinción que más se acepta, aunque el procedimiento es largo. A fin de obtener buenas tinciones se recomienda usar el fijador de Schaudinn.
Reactivos
Solución concentrada A
- Hematoxilina 10.0 g
- Etanol absoluto 1 000.0 ml
- Solución concentrada B
- Sulfato ferroso de amonio 10.0 g
- Sulfato férrico de amonio 10.0 g
- Ácido clorhídrico 10.0 ml
- Agua destilada 1 000.0 ml
Solución de trabajo
- Solución concentrada A 15.0 ml
- Solución concentrada B 15.0 ml
Procedimiento
- En un portaobjetos hacer un frotis y emulsionarlo con solución salina isotónica; es necesario que la capa quede delgada. Antes de que las heces se sequen, se fija con Schaudinn durante 60 minutos (se pueden dejar toda la noche en el fijador).
- Para eliminar los cristales del cloruro de mercurio, las preparaciones se colocan en una solución de etanol a 70%-yodo durante cinco minutos. La solución de alcohol- yodo se prepara añadiendo unas gotas de yodo (3%) al etanol (70%). Después, las laminillas se colocan en un vaso Coplin que contenga etanol a 95%, y otro con etanol a 70% (en ambos pasos durante cinco minutos). Se lavan con agua durante 10 minutos.
- Los portaobjetos se colocan en la solución de trabajo durante cinco minutos.
- Se lavan con agua durante 10 minutos.
- Se deshidratan en etanol a 70, 95% y en etanol absoluto (cada paso será de cinco minutos).
- Las laminillas se transfieren a xileno durante 10 minutos. Se cubren con bálsamo de Canadá, colocar un cubreobjetos del número 1 y dejan secar.
Tinción negro de clorazol
Fundamento
Esta técnica fija y tiñe las estructuras parasitarias, por lo que se recomienda utilizarla con muestras de materia fecal sin fijador.
Reactivos
Solución A
- Etanol (90%) 170.0 ml
- Metanol (100%) 160.0 ml
- Ácido acético glacial 20.0 ml
- Fenol líquido 20.0 ml
- Ácido fosfotúngstico (1%) 12.0 ml
- Agua destilada 618.0 ml
Solución B
- Negro de clorazol 5.0 g
- Solución A 1 000.0 ml
El colorante (negro de clorazol) se tritura con algunos ml de la solución A y se sigue agregando la solución hasta obtener una pasta sin grumos, se deja sedimentar y el sobrenadante se vacía en otro recipiente. Se sigue moliendo y se vacía hasta que todo el colorante esté en solución, Antes de usarse debe almacenarse (madurar) de cuatro a seis semanas.
Procedimiento
- En un portaobjetos hacer un frotis con las heces (evitar que se seque) y sumergirlo en el colorante de negro de clorazol durante una a dos horas.
- El portaobjetos se coloca en etanol al 95% durante cinco minutos. Después en etanol al 100% por cinco minutos (este paso se repite una vez más).
- Se pasa al tolueno o xileno durante cinco minutos (repetir una vez).
- Las preparaciones se cubren con resina o bálsamo de Canadá, se coloca un cubreobjetos del número 1 y se dejan secar.